La diabetes mellitus es un conjunto de enfermedades metabólicas de etiología y clínica heterogénea, caracterizadas por hiperglucemia como resultado de defectos en la secreción de insulina, la accíón de la misma o ambas. La hiperglucemia crónica en la diabetes se asocia con lesiones a largo plazo, fundamentalmente en los ojos, riñón, sistema nervioso y corazón. El Comité de expertos para el diagnóstico y la clasificación de la diabetes de la Asociación Americana de Diabetes recomienda en base al conocimiento de que disponemos una clasificación etiológica, frente a la tradicional terapéutica (insulinodependiente y no insulinodependiente). Así, pueden considerarse los siguentes tipos de Diabetes Mellitus:
- Diabetes tipo 1 (etiología autoinmune o idiopática)
- Diabetes tipo 2 (producción insuficiente o resistencia a la insulina)
- Otros tipos específicos (defectos genéticos que afectan a la función de las células beta, o la acción de la insulina, asociada a alteraciones del pancreas exocrino, asociada a endocrinopatías, inducida por fármacos, asociada a infecciones, asociada a síndromes genéticos)
- Diabetes Gestacional
La diabetes de tipo 2 constituye una patología muy prevalente entre las personas maduras. Se estima que el 20% de los mayores de 75 años la padecen en mayor o menor medida. Además, cada día es mayor la evidencia acumulada de que la resistencia a la insulina o la hiperinsulinemia resultante está estrechamente relacionada no sólo con la diabetes de tipo 2, sino con el denominado síndrome X o síndrome de resistencia a la insulina, que incluyen hipertensión, dislipemia e hipercoagulación.
Tanto para el personal sanitario como para el paciente es menos importante el etiquetar correctamente el tipo de diabetes que entender la patogénesis de la hiperglucemia y tratarla eficazmente.
El tratamiento farmacológico de la diabetes mellitus puede resumirse como sigue:
- Aporte exógeno de insulina (humana o animal).
- Aumento de la sensibilidad a la insulina endógena: Biguanidas; Tiazolidindionas
- Aumento de la secreción/liberación de insulina endógena: Sulfonilureas; Carbamoilmetilbenzoatos y análogos
- Reducción de la absorción digestiva de glucosa: Inhibidores de las a–glucosidasas; Fibra vegetal y derivados.
INSULINAS
Las insulinas de origen bovino o porcino han desaparecido prácticamente del mercado, desplazadas por insulinas humanas obtenidas por ingeniería genética. Todos los preparados actuales son del tipo monocomponente, es decir, han sido sometidas a un proceso de ultrapurificación para eliminar todo tipo de proteínas extrañas. Por tanto la única diferencia entre insulinas digna de ser tenida en consideración es la duración de acción.
Métodos para prolongar la acción de la insulina:
Dada la gran rapidez de destrucción de la insulina (semivida plasmática inferior a nueve minutos) es necesario utilizar sistemas para prolongar la acción. Se recurre a preparados inyectables por vía subcutánea, que liberan lentamente insulina desde el punto de inyección. Hay dos procedimientos para ello:
- Unión a otras proteínas: Hoy día se utiliza exclusivamente la protamina.
- Cristalización controlada: Mediante adición de zinc y manipulando el pH del medio de cristalización, puede conseguirse que la insulina precipite controlando el tamaño de los cristales. Con estos precipitados se preparan suspensiones de insulina-zinc para inyección, que liberan la hormona tanto más lentamente cuanto mayor sea el tamaño de los cristales.
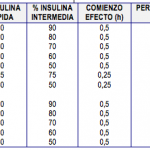
Los preparados obtenidos por estos procedimientos se suelen clasificar de acuerdo con la duración de la acción en rápidas, intermedias y lentas. El Cuadro I recoge las insulinas comercializadas, clasificadas según este criterio e incluyendo los principales parámetros farmacocinéticos. Es importante recordar que todas las insulinas retardadas (en suspensión translúcida) se aplican por vía subcutánea. Sólo la insulina no retardada (en solución transparente) puede inyectarse intravenosamente.
Métodos para acelerar la acción de la insulina:
La insulina lispro es una modificación biosintética de la insulina natural que consiste en intercambiar los aminoácidos en posición 28 y 29 de la cadena B (lisina y prolina). La insulina así modificado tiene menos tendencia que la natural a formar hexámeros en solución. Como los hexámeros tienen que disociarse antes de que la insulina sea absorbida del punto de inyección, el resultado práctico es que la insulina lispro tiene comienzo más rápido y duración de acción más corta que la insulina soluble normal. Esto tiene interés dentro de los esquemas actuales de control estricto de glucemia que trataremos más adelante.
MEZCLAS DE INSULINA
Existen en el mercado mezclas preparadas de insulina rápida con intermedia, con el propósito de obtener un medicamento de comienzo rápido y larga duración. Estos preparados, llamados insulinas bifásicas, se adaptan bien por otra parte a los criterios modernos de dosificación de insulinas (ver más abajo).
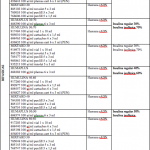
Las insulinas bifásicas comercializadas figuran recogidas en el Cuadro II. Las insulinas-zinc se prestan peor a estas combinaciones porque el zinc residual tiende a retrasar la acción de la insulina normal.
ADMINISTRACIÓN DE INSULINAS
La vía usual de administración de insulinas es la subcutánea. Excepcionalmente (como antidiabético) se recurre a la vía IV.
El método más corriente de administración es mediante jeringuillas especiales graduadas en unidades de insulina. Han alcanzado aceptación los aparatos inyectores en forma de pluma estilográfica, que facilitan los regímenes de varias inyecciones al día. Existen también jeringas precargadas capaces de dosificar con precisión en incrementos de 2 UI y útiles para varias aplicaciones (cambiando la aguja).
Las bombas de infusión administran de forma contínua una dosis basal de insulina vía SC, suplementada por dosis extra antes de las comidas. Están menos difundidas: son útiles sobre todo para pacientes muy motivados. Se les adscribe con un cierto aumento de frecuencia de episodios de cetoacidosis, tal vez relacionados con fallos de funcionamiento.
Las insulinas españolas para administración por jeringuilla están estandarizadas a la dosis de 100 UI/ml en viales de 10 ml. Los cartuchos para inyectores y bombas de infusión tienen una concentración de 100 UI/ml y el volumen está ajustado a las características técnicas del aparato.
Cuadro I. Tipos de Insulina
Cuadro II. Insulinas Bifásicas
INSULINAS COMERCIALIZADAS EN ESPAÑA
PAUTAS DE DOSIFICACIÓN
La difusión de la idea de que el control estricto de la glucemia puede prevenir las complicaciones a largo plazo de la diabetes (ver el apartado PREVENCIÓN DE COMPLICACIONES) ha creado una tendencia a usar pautas posológicas orientadas a ajustar lo más estrechamente que se pueda la administración de insulina a las variaciones diurnas de la glucemia.
Esto implica regímenes de varias inyecciones diarias y control de glucemia por el propio enfermo. Las pautas más utilizadas en la actualidad son:
1.- Dos dosis (antes del desayuno y por la tarde), de una mezcla de insulina intermedia e insulina rápida. La popularidad de este régimen explica la difusión de los preparados de insulinas bifásicas.
2.- Una dosis diaria de insulina de acción prolongada (por la mañana o por la noche, sustituida a veces por una dosis de insulina intermedia al acostarse) y tres inyecciones de insulina rápida al día antes de las principales comidas. Este régimen necesita pacientes motivados, pero tiene la ventaja de permitir horarios de comidas más flexibles. Se han introducido sistemas para minimizar sus inconvenientes. Uno son los inyectores de tipo estilográfica. Otro es la insulina lispro, que puede usarse al justo inicio de la comida, mientras que con la insulina normal hay que hacer la previsión de inyectarla media hora antes de comer.
FINANCIACIÓN POR EL SISTEMA NACIONAL DE SALUD
Todas las insulinas son prescribibles por Seguridad Social. En lo referente a los equipos de aplicación, las jeringuillas y agujas no pueden dispensarse a través de farmacias pero se distribuyen gratuitamente en centros de atención primaria y ambulatoria.
Como regla general, el SNS no reembolsa bombas de insulina ni equipos de inyección tipo estilográfica. Algunas áreas de salud pueden hacerlo ocasionalmente, dependiendo de disponibilidad presupuestaria. Las agujas de los equipos se pueden conseguir gratuitamente en centros de atención primaria.
Los equipos de inyección en forma de jeringa precargada se consideran especialidades farmacéuticas y son prescribibles como tales. Las agujas adicionales se distribuyen gratuitamente en centros de atención primaria.
ANTIDIABÉTICOS ORALES
Biguanidas
El modo de acción no es bien conocido. Precisan de insulina para ser efectivas, pero no estimulan la producción pancreática. Tal vez el mecanismo principal resida en el incremento de la captación periférica de la glucosa al hacer aumentar el número de receptores tisulares de insulina, pero otros mecanismos propuestos son: una reducción de la absorción oral de glúcidos; un aumento de la captación muscular de glucosa y la reducción de la gluconeogénesis hepática.
Los medicamentos del grupo que quedan en el mercado son buformina y metformina. Fenformina fue retirada por su especial relación con el efecto adverso más peligroso de estos fármacos: la acidosis láctica. La incidencia de acidosis láctica es considerablemente menor con los otros medicamentos, especialmente con metformina, que es el más experimentado y se considera por ello de elección. El riesgo de acidosis láctica se minimiza respetando estrictamente los criterios de exclusión que figuran en el Cuadro III.
Cuadro III. Criterios de exclusión de tratamientos con Biguanidas:
|
Sulfonilureas y productos relacionados
Actúan en primera instancia estimulando la secreción de insulina. Esto significa que para que sean eficaces debe existir un mínimo de función pancreática (no tienen efecto en pacientes pancreotomizados). Existe evidencia de que las sulfonilureas tienen una segunda acción a largo plazo aumentando la respuesta metabólica a la insulina circulante, posiblemente por inducir la formación de nuevos receptores celulares de insulina, o bien por aumentar la sensibilidad de los ya existentes. Las sulfonilureas se suelen dividir en dos grupos:
| PRIMERA GENERACIÓN | SEGUNDA GENERACIÓN |
| Clorpropamida
Tolbutamida |
Glibenclamida
Gliclazida Glimepirida Glipizida Gliquidona Glisentida |
Esta división puede dar lugar a confusión porque es puramente cronológica y apenas existe la cualidad de innovación terapéutica que el término generación parece implicar. Las sulfonilureas más modernas son más potentes que las de la primera generación, pero ello se traduce simplemente en la administración de dosis menores[1]. La acción hipoglucemiante es la misma. Los efectos secundarios también. La única propiedad interesante es que la unión a proteínas plasmáticas de muchas sulfonilureas de segunda generación es de tipo no iónico, y por tanto, son menos susceptibles a las interacciones medicamentosas que los antidiabéticos más antiguos, los cuales pueden ser desplazados de la unión a proteínas plasmáticas por fármacos como la warfarina o los salicilatos, dando lugar a cuadros hipoglucémicos.
Por consiguiente, es útil prescindir del criterio generacional y considerar a las sulfonilureas como un conjunto homogéneo donde la característica diferencial más importante es la farmacocinética, especialmente la duración de acción y la vía metabólica principal.
En la duración de acción hay que considerar dos factores: cuanto más larga sea, tantas menos dosis hay que administrar al día y más cómoda es la administración. Pero por el contrario, si se produce un episodio hipoglucémico, éste será más prolongado.
Por ello, pese a la comodidad de la dosis única diaria, es prudente a veces recurrir a sulfonilureas de acción corta (por ejemplo: en pacientes ancianos con hábitos dietéticos irregulares).
En cuanto a la vía metabólica, la mayor parte de las sulfonilureas sufren biotransformación hepática, pero algunas se eliminan intactas por vía renal. Esto debe tenerse en cuenta en pacientes con insuficiencia renal porque podría producirse un efecto acumulativo.
No existiendo circunstancias especiales, algunos autores prefieren comenzar con glibenclamida por tener una serie de condiciones bastante atractivas como son duración de acción adecuada, un margen de dosis amplio y mínima posibilidad de interacción por desplazamiento de la unión a proteínas plasmáticas. La clorpropamida es un medicamento tradicional que sigue siendo muy usado, pero debida a su larga semivida hay que tener precaución en ancianos y pacientes con insuficiencia renal.
En cualquier caso, la selección depende de la experiencia del clínico más que de cualquier otro factor. En la tabla siguiente figuran las características farmacocinéticas de las sulfonilureas más representativas.
| Medicamento | Eliminación | Duración acción (h) | Dosis (mg/día) |
| Clorpropamida | Hepática y renal | 24-72 | 100-500 (una vez al día) |
| Tolbutamida | Hepática | 6-12 | 500-2.000 (tres veces al día) |
| Glibenclamida | Hepática | 12-16 | 2,5-20 (1-2 veces al día) |
| Glimepirida | Hepática y renal | 24 h. | 1-4 mg (una vez al día) |
| Gliclazida | Hepática | 12-18 | 40-320 (una vez al día) |
| Glipizida | Hepática | 6-10 | 2,5-30 (1-2 veces al día) |
| Gliquidona | Hepática | 2-4 | 45-280 (1-3 veces al día) |
Pérdida de eficacia de las Sulfonilureas: Hay que esperar que hasta un 20% de los pacientes no van a responder al tratamiento inicial (fracaso primario). De los que tienen respuesta satisfactoria, aproximadamente un 5% de pacientes cada año van a fallar en el control de la glucemia (fracaso secundario). Bastantes veces los fracasos secundarios pueden resolverse cambiando a otra sulfonilurea. En casos extremos se añade una biguanida al régimen de las sulfonilureas o se ensaya la acarbosa, pero muchos de los pacientes que precisan terapia combinada terminan necesitando insulina.
Inhibidores de la alfa glucosidasa
La goma guar y los inhibidores de las alfaglucosidadas pretenden controlar la glucemia actuando sobre el proceso de absorción de los carbohidratos de la dieta.
Acarbosa y miglitol son un inhibidores de las a-glucosidasas, un grupo de enzimas presentes en las vellosidades intestinales, que catalizan la formación de glucosa a partir de la sacarosa y de los oligosacáridos que se producen en la hidrólisis digestiva del almidón. Se toma en comprimidos junto con cada comida.
El efecto principal de ambos es aplanar la curva de glucemia, de tal forma que el pico posprandial es menos pronunciado. El descenso de glucemia postprandial con la acarbosa es del mismo orden que con los antidiabéticos orales. El efecto de la goma guar es más modesto y se discute incluso que exista. La influencia de cualquiera de los dos medicamentos en la glucemia en ayunas es muy escasa.
Los efectos adversos derivan de que los carbohidratos no absorbidos son objeto de fermentación bacteriana en el colon: meteorismo, distensión abdominal, diarrea, etc.
En términos de eficacia demostrada y de tolerancia, los inhibidores de las alfaglucosidasas parecen claramente preferibles a la goma guar, pero en cualquier caso no está bien definido el papel de estos fármacos en la terapia antidiabética. Estos fármacos son capaces de reducir la glucemia posprandial, produciendo además un modesto efecto sobre la glucemia en ayunas. Todo ello conduce a una leve pero significativa disminución de la hemoglobina glucosilada (Hb1Ac), uno de los principales marcadores biológicos de la diabetes mellitus.
Por todo ello, los inhibidores de las alfaglucosidasas tienen interés terapéutico (solos o asociados a otros antidiabéticos) en los casos recientemente diagnosticados de diabetes no insulino-dependiente (diabetes de tipo 2 o «de madurez»), así como en aquellos otros casos de pacientes mal controlados con otros tratamientos, o incluso como una alternativa a los otros antidiabéticos orales convencionales en pacientes bien controlados pero con riesgos elevados de hipoglucemia (sulfonilureas) o de acidosis láctica (biguanidas).
Tiazolidindionas
Actúan uniéndose selectivamente al receptor hormonal nuclear PPARg (receptor gamma activado por el proliferador de peroxisomas), lo que implica una regulación genética a nivel de transcripción. La activación de los receptoras PPARg regula la transcripción de los genes responsables de las acciones celulares de la insulina, especialmente aquellos implicados en el control de la producción, el transporte y la utilización de glucosa.
El receptor PPARg está expresado predominantemente en las células del tejido adiposo, uno de los principales objetivos fisiológicos de la insulina. Sin embargo, también puede ser encontrado en macrófagos, células musculares lisas vasculares, células endoteliales y algunas líneas celulares cancerosas.
La activación del receptor PPARg por las tiazolidindionas incrementa la sensibilidad de las células a la insulina, pero también modula la producción de citocinas proinflamatorias por los macrófagos, así como la proliferación y migración de las células musculares lisas vasculares, y el crecimiento o diferenciación de las células neoplásicas.
Las tiazolidindionas son capaces de reducir la glucemia tanto en monoterapia como en asociación con sulfonilureas, biguanidas o insulina. En España se ha autorizado su uso exclusivamente en asociación a biguanidas (metformina) o, en caso de intolerancia a estas últimas, a sulfonilureas.
Otros antidiabéticos orales
La repaglinida y la nateglinida presentan un perfil farmacológico y toxicológico similar al de las sulfonilureas, si bien parece que son capaces de controlar algo mejor la hiperglucemia posprandial, aunque precisan una dosificación repartida a lo largo del día, coincidiendo con las principales comidas. Teóricamente, repaglinida y nateglinida tienden a producir menos desensibilización de las células beta pancreáticas que las sulfonilureas. No obstante, este efecto, cuya evidencia científica no es muy consistente, puede atribuirse más a la corta duración de efectos de estos fármacos, que a efectos metabólicos específicos.
La goma guar es una fibra soluble de origen vegetal que mezclada con agua forma un mucílago muy viscoso no absorbible. El mecanismo de acción no es bien conocido. Posiblemente el aumento de viscosidad del contenido intestinal dificulte la acción de los enzimas pancreáticos, o bien retenga la glucosa en el lumen intestinal. Se toma disperso en 1/4 de litro de agua, o se espolvorea en la comida. En ningún caso debe ingerirse como polvo seco por el riesgo de obstrucción esofágica.
Criterios de utilización de antidiabéticos orales
Los antidiabéticos orales sólo se usan en diabetes no dependiente de insulina («de madurez» o tipo 2) estable, no complicada con cetosis. Sulfonilureas y biguanidas tienen potencia hipoglucémica muy parecida. Es difícil llegar a la normalización de la glucemia con cualquiera de ellas si se parte de cifras en ayunas superiores a los 2 g/l.
El uso de las biguanidas ha estado mucho tiempo restringido por la aparición de acidosis láctica, un efecto secundario con índice de mortalidad superior al 25%. En estos momentos está en recuperación, por la sustitución de la fenformina (que ha desaparecido del mercado) por la metformina, que tiene una incidencia de acidosis láctica entre 10 y 20 veces menor. Se valoran por otra parte las propiedades beneficiosas de las biguanidas, como son no aumentar la insulinemia, inducir pérdida de peso y no producir apenas cuadros de hipoglucemia. Se considera que si se respetan estrictamente los criterios de exclusión de los tratamientos, el riesgo de un accidente grave por acidosis láctica con metformina es del mismo orden que el de un cuadro hipoglucémico con sulfonilureas.
La mayoría de los autores aconsejan intentar corregir la hiperglucemia a base de dieta, ejercicio y pérdida de peso, y recurrir a los antidiabéticos únicamente en los casos donde no sean suficientes las medidas dietéticas. Comenzar con sulfonilureas es una práctica usual, aunque debe considerarse la metformina en pacientes obesos.
En caso de fracaso secundario de la sulfonilurea, la asociación con metformina o con acarbosa puede tener efectos aditivos y es posible así prolongar el control. En último caso se recurre a la insulina. Está siendo muy ensayado el régimen llamado BIDS (insulina al acostarse y sulfonilurea durante el día). La administración nocturna de una dosis de insulina de acción intermedia (incrementada gradualmente hasta obtener una glucemia en ayunas de 1,5 g/l o menos) y de un régimen diurno de sulfonilurea es más cómodo que los regímenes intensivos de insulina que se usan hoy en diabetes de tipo I, pero en última instancia hay que transferir el paciente a uno de ellos.
La introducción de los carbamoilmetilbenzoatos no ha modificado sustancialmente el panorama del tratamiento de la diabetes de tipo 2, aunque puede mejorar levemente el control de la hiperglucemia posprandial, unos de los problemas típicos de estos pacientes, al estimular más rápidamente la secreción de insulina que las sulfonilureas.
Por lo que respecta a las tiazolidindionas, su papel terapéutico está circunscrito, por el momento, a su uso en combinación para el tratamiento oral de la diabetes mellitus de tipo 2 en pacientes con control glucémico insuficiente a pesar de recibir la dosis máxima tolerada en monoterapia con metformina o sulfonilurea. Por ello, se emplea en combinación con metformina sólo en pacientes obesos o en combinación con sulfonilurea sólo en pacientes con intolerancia a metformina o en los que metformina está contraindicada.
Prevención de complicaciones de la diabetes
Está perfectamente demostrado que la hiperglucemia es la principal responsable de las complicaciones de la diabetes: retinopatía, nefropatía y neuropatía. En consecuencia un control estricto de la glucemia debe prevenirlas.
Un control estricto a base de un mínimo de cuatro medidas de la glucemia y tres inyecciones de insulina al día se traduce en una disminución del 76% en el riesgo de aparición de retinopatía, en una disminución del 54% en la progresión de retinopatía declarada, un 39% de disminución de la ocurrencia de microalbuminuria y de un 60% de la aparición de neuropatía clínica, comparado con el tratamiento convencional de la diabetes insulinodependiente.
Aparte de las molestias, el principal inconveniente del tratamiento intensivo es que aumentan de 2 a 3 veces los episodios de hipoglucemia severa.
Estas conclusiones se refieren exclusivamente a la diabetes insulino dependiente. El tratamiento intensivo de diabéticos no insulino-dependientes es objeto de debate. Hay acuerdo en que las complicaciones específicas de la diabetes son de la misma naturaleza y por lo tanto las conclusiones de los ensayos en diabetes insulino-dependientes son aplicables también. Sin embargo la cuestión no está tan clara en las complicaciones macrocirculatorias no específicas (arterioesclerosis, enfermedad coronaria). Muchos autores temen que puedan ser agravadas por la administración de la insulina. El control de peso puede ser también más difícil. Hay ensayos clínicos en marcha en diabetes no insulino-dependiente, pero los resultados definitivos no están disponibles aún. La situación actual es una tendencia a intensificar el tratamiento convencional (dieta, control de peso, antidiabéticos orales si es necesario) para conseguir un control más estricto de la glucemia. No hay criterios uniformes de actuación en los pacientes donde el tratamiento convencional es insuficiente y requieren insulina.
IECA en nefropatía diabética
La nefropatía diabética es la complicación que parece menos afectada por el control estricto de la glucemia, probablemente porque influyen otros factores. Uno de ellos es la tensión. Se sabía que el tratamiento antihipertensivo retrasa la progresión de la nefropatía. Recientes ensayos han mostrado que los inhibidores de la angiotensina convertasa (IECA) pueden reducir la microalbuminuria y retrasar la progresión de la nefropatía independientemente de las cifras tensionales y en cualquier estadio del proceso. De hecho, el benazeprilo ha sido autorizado para el tratamiento de la insuficiencia renal crónica.
Parece haber una base sólida para que los IECA sean la primera elección en el tratamiento de la hipertensión asociada a diabetes, pero serán precisos más estudios para determinar la utilidad en diabéticos normotensos. En particular no se ha establecido la dosis óptima, ni se sabe con precisión el grado de protección que ofrecen. Los ensayos clínicos han usado dosis entre 40 y 100 mg/día de captoprilo. Hay tendencia a usar dosis mayores cuanto mayor sea la albuminuria, lo cual es una práctica lógica pero no contrastada por ensayos controlados.
[1] Las dosis típicas de las sulfonilureas de primera generación son de 100 a 250 mg, las de segunda de 2,5 a 20 mg.
El contenido aquí mostrado corresponde a BOT (base de datos de medicamentos de España 2002), que aunque está relacionado con medicamentos de uso humano, puede resultar muy útil para la medicina veterinaria de pequeños animales.



 Campus Virtual del Hospital Veterinario J. Griñán
Campus Virtual del Hospital Veterinario J. Griñán